Dr. Armand Hausmann – Ihr Psychiater in Innsbruck
Behandlung von Bipolaren Erkrankungen – Die Lithiumtherapie
Klinische Wirksamkeit: Indikationen zum klinischen Einsatz von Lithium
Lithium kann bei der akuten Manie einsetzt werden, auch wenn Antipsychotika klinisch einfacher zu handhaben sind und hier der Wirkungseintritt deutlich früher eintritt. Wenn Lithium in die phasenprophylaktische Therapie überführt werden soll, stellt Lithium (oder Valproat) ein erste Wahl Medikament dar. Wenn eine schwere manische Episode vorliegt kann Lithium als Augmentation einem neueren Antipsychotikum hinzugefügt werden. Dysphorische oder gemischte manische Zustände sprechen weniger gut auf Lithium an als klassisch euphorische Manien. Psychotische Symptome sind kein Hindernis Lithium mit Erfolg einzusetzten, auch wenn die gängige Praxis hier ein Antipsychotikum bevorzugt.
Als Monotherapie sollte Lithium bei der akuten uni- und bipolaren Depression nicht eingesetzt werden. Aber für eine Augmentation zu einem Antidepressivum ist die Evidenz sehr gut. Die Daten zur Rezidivprophylaxe manischer Episoden sind gut, die zur Prophylaxe depressiver Rezidive inkonkludent. Die Prophylaxe bei Bipolar II Patienten, scheint erfolgreich zu sein. Keine Empfehlung zum prophylaktischen Einsatz bei rapid cycling Verläufen. Exzellente Lithium Responder, dies betrifft ungefähr 1/3 der mit Lithium Behandelten, sind Patienten deren Leben durch Lithium Prophylaxe vollkommen verändert wurde da totale Reduktionen der Symptome über einen Zeitraum von 30 Jahren berichtet wurden. Exzellente Lithium Responder werden als Endophänotypen der bipolaren Erkrankung angesehen. Lithium besitzt eine gut dokumentierte anti-suizidale Wirksamkeit und sollte bei gefährdeten Patienten eingesetzt werden. Die Behandlung psychiatrischer Erkrankungen mit Lithium bei älteren Patienten ist phasenprophylaktisch so wirksam wie in der Allgemeinbevölkerung und besitzt auch im Alter einen suizidpräventiven Charakter. Eine Ultra-Langzeitgabe von Lithium bei alten Patienten ermöglichte allen Patienten ein gutes berufliches und psychosoziales Funktionsniveau. Und trotzdem wird Lithium von vielen Kollegen bei dieser Patientengruppe nur zögerlich eingesetzt da hier gravierende Nebenwirkungen befürchtet werden.
Lithium-Serumspiegel
Gegenstand von Diskussionen ist noch das Statement, dass niedrigere Plasmaspiegel (≤ 6 mmol/l) ausreichen um depressive Phasen verhindern. Konsens besteht auf jeden Fall über die niedrigst phasenprophylaktisch wirksame Dosierung von 0,4 mmol/l. Auf Grund der engen therapeutischen Breite von Lithium ist eine regelmäßige Überwachung des Plasmaspiegels von großer Bedeutung.
Exakte Lithiumspiegel sind nur dann zu bestimmen, wenn die Blutprobe am Morgen ohne vorherige Tbl. Einnahme möglichst genau 12 Stunden nach der letzten Einnahme am Abend das Blut abgenommen wird.
Die Patienten müssen zum Zeitpunkt der Blutentnahme nicht nüchtern sein, d.h. sie können zuvor frühstücken und Tee oder Kaffee trinken.
Am Tag vor der Blutentnahme sollte der Patient die letzte Tablette deshalb möglichst genau 12-Stunden-Intervall einnehmen. (Beispiel: letzte Tabletteneinnahme 20 Uhr, Blutprobe 8 Uhr).
Die Dosierung bei älteren Patienten soll reduziert werden
Eine der Ursachen besteht in einem Rückgang der Körperflüssigkeit mit zunehmendem Alter, mit dementsprechender Erhöhung der Lithiumkonzentration. Eine zweite Ursache besteht in der Tatsache, dass Lithium über die Nieren ausgeschieden wird und das die glomeruläre Filtrationsrate mit dem Alter abnimmt, auch dadurch entstehen höhere Lithum-Plasmakonzentrationen mit höherer Wahrscheinlichkeit von LithiumtoxizitätEine andere Ursache eines erhöhten Risikos einer Lithiumintoxikation besteht in Medikamenteninteraktionen. Dies ist von klinischer Bedeutung, da es zu pharmakokinetischen Interaktionen zwischen Lithium einerseits und Thiaziddiuretika, Angiotensin-Converting-Enzym Inhibitoren und nicht-steroidalen Antiphlogistika kommt, Medikamente die bei Älteren öfters in Verwendung stehen.
Absetzen der Lithiumtherapie
Klinisches Management bei Lithiumtherapie
Vor Beginn der Therapie:
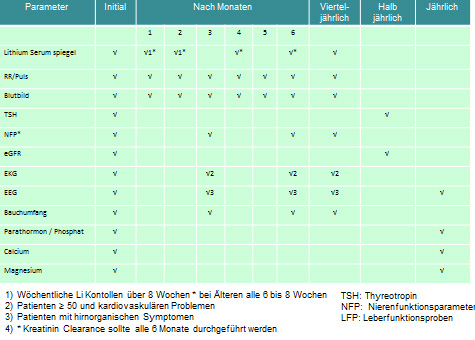
Die Erhebung der eigenen und familienanamnestischen Belastung mit Schildrüsendysfunktion, Herzerkrankunge, sowie Komedikationen. An Laborwerten sollen erhoben werden: renale Kreatinin Clearance, eGFR, TSH sowie T3 und T4, Calcium, Magnesium Phosphat, Parathormon, Glucose und Elektrolyte. Bei potentiell gebährfähigen Frauen sollte ein Schwangerschaftstest durchgeführt werden. Bei Implementierung von Lithium sollte eine Kontrazeption durchgeführt werden. Ein EKG bei über Vierzigjährigen, ein EEG bei einer Vorgeschichte einer Epilepsie oder epileptischer Anfälle, sollten ebenfalls veranlasst werden.
Bei Beginn der Therapie:
Diverse Strategien wurden berichtet. Die allgemeinen Empfehlungen bei nicht akuter Symptomatik bestehen darin mit kleinen geteilten täglichen Dosen bis zu 450 mg/d zu beginnen um dann die Dosis nach Plasmaspiegel-Kontrolle zu adjustieren. Bei Lithium naiven Patienten sollten niedrigere Plasmaspiegel von 0,8-1,0 mmol/l angestrebt werden um interindividuelle Unterschiede auszugleichen. Bei akuten manischen Episoden empfiehlt es sich, bei mit einer Anfangsdosis von mindestens 900 mg Lithium pro Tag zu beginnen. Dieses Vorgehen wird im angloamerikanischen Sprachraum als „loading dose“ bezeichnet. In der Akutbehandlung der Manie werden Lithium-Plasmakonzentrationen von 1,0 bis 1,2 mmol/l angestrebt. Bei einem Spiegel oberhalb von 1,2 mmol/l kann es zu Intoxikationserscheinungen kommen.
Während der Initiierung von Lithium oder nach Steigerung der Dosis sollte ein Lithium Plasmaspiegel nach Erreichen eines „steady states“ nach frühestens 5 Tagen, manche Autoren empfehlen eine Woche zu warten, erhoben werden. Dann sollte eine Kontrolle 1x pro Woche über 6 Wochen erfolgen. Die Blutabnahme sollte 12 Stunden (10-14 Stunden) nach letzter Lithium-Einnahme erfolgen. Die ISBD (International Society for Bipolar Disorders) empfiehlt 2 konsekutive Werte bei gleichbleibender Dosis zu erheben
Eine Umstellung einer Zweimalgabe auf eine Einmaldosis zur Nacht hilft die Dosis um 25% und dementsprechend Nebenwirkungen zu reduzieren. Überdies kann man dadurch die Adhärenz steigern. Die Aussicht auf eine potentielle Reduktion eines progressiven strukturellen Schadens am Nierentubulus sollte ebenfalls zur Umstellung ermutigen. Die Reduktion der Nebenwirkungen wird nicht durch ev. affektive Destabilisierung teuer erkauft.
In diesem Kontext ist es auch wichtig nicht nur die peripheren Plasmakonzentrationen mit ins Kalkül zu ziehen. Die Halbwertszeit von Lithium in neuralem Gewebe ist länger als die im Plasma. Während Plasma-Lithiumkonzentrationen Konzentrationsspitzen 4-12 Stunden nach Einnahme erreichen, erreichen, wegen der Blut-Hirnschranke, die Lithiumkonzentrationen im ZNS erst nach 24 Stunden den Peak. Der Peak fällt im Gehirn auch weniger ausgeprägt aus wie im Plasma (Ratio 0,5). Auch wird Lithium im neuronalen Gewebe im Vergleich zum Plasma wegen einer längeren Halbwertszeit von 30 Stunden später eliminiert. Nach 24 Stunden steigen die Lithiumkonzentrationen im Gehirn auf 1,0 und steigt noch bis zur 48ten Stunde an. Die tägliche Einmalgabe wird also ausreichen um wirksame Spiegel im zentralen Nervensystem aufrecht zu erhalten und so die stimmungsstabilisierende Wirkung von Lithium zu gewährleisten.
Es sollten tägliche Dosen gegeben werden. Dosierungschemata die sich mit einer Dosis nur jeden zweiten Tag begnügen, bewirken höhere Rezidivraten (48% vs. 20%), kürzere Zeiträume bis zum Rezidiv (48 vs. 65 Wochen), wie Dosierungen die täglich vorgenommen werden. Auch sind in diesem Fall die Anzahl der euthymen Patienten nach 3 Monaten im Vergleich zur Gruppe mit täglicher Gabe deutlich geringer (48% vs. 87%).
Therapeutisches Monitoring in der Phasenprophylaxe:
Die Kontrolle der Plasmaspiegel in der Phasenprophylaxe sollte bei gesunden Patienten vierteljährig erfolgen. Bei älteren oder multimorbiden Patienten alle 6-8 Wochen.
Bei der zusätzlichen Gabe von Medikamenten, die den Natrium-Haushalt beeinflussen (Diuretika, ACE-Hemmer, nichtsteroidale Antirheumatika (NSAR) ist Vorsicht geboten, da Natrium und Lithium als jeweils einfach geladene Kationen um die tubulären Rückresorptionsmechanismen konkurrieren. Bei Diuretika, insbesonders Thiaziddiuretika erhöhen die Lithium-Plasma-Spiegel um 20-40%. Vorsicht vor Überdosierung ist ebenfalls geboten bei Flüssigkeitsverlust (Schwitzen, Diarrhö, Fieber, Erbrechen), bei salzarmer Diät, sowie Narkosen und operativen Eingriffen. Die Kontrolle der Schilddrüsenparameter (TSH ggf. T3/T4) sollte halbjährlich erfolgen. Diejenige der Nebenschilddrüse (Calcium, Parathormon; Phosphat) 1x pro Jahr.
Lithium Nebenwirkungen
Akute Nebenwirkungen betreffen hauptsächlich die Nieren. Prinzipiell wird zwischen akuter und chronischer lithiumbedingter Nierenschädigung unterschieden.
Akute renale Nebenwirkungen: Zu den akuten NW sind zu rechnen die Polyurie/Polydipsie, eine reduzierte renale Konzentrationsfähigkeit sowie die akuten Intoxikationen mit akutem Nierenversagen die sich auf chronische Nephropathien aufpfropfen oder zu einer chronischen Nephropathie führen können.
Chronische Nebenwirkungen: Hierzu sind zu zählen der sich aus einer anhaltenden Polyurie entwickelnde nephrogene Diabetes insipidus (NDI), sowie die chronische Nephropathie (CKD) und das Endstadium einer Niereninsuffizienz (ESRD).
Die häufigste akute Nebenwirkung ist die Polyurie/Polydipsie. Eine Einmalgabe eines nicht retardierten Präparats hat am Abend ein reduziertes Ausscheidungs-Volumen zur Folge hat. Um das Harnvolumen zu reduzieren ist die niedrigste wirksame Lithium Dosis anzustreben. Es konnte auch eine um 15% erniedrigte max Konzentrationsfähigkeit (Umax) im Vergleich zu Kontrollen dokumentiert werden.
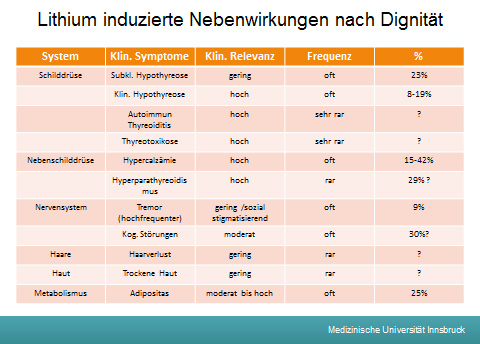
Dauert die Symptomatik über 6 Jahre kann es zu einem irreversiblen nephrogenen Diabetes insipidus (NDI) führen. Der Lithium-induzierte NDI kommt bei 15-20% der Patienten vor und ist mit einem 3-fach erhöhten Risiko eine chronische Niereninsuffizienz (CKD) zu entwickeln assoziiert. Es gibt nur wenige pharmakokinetische Daten zum NDI bei Älteren. Die Daten schwanken stark, je nach Kriterien sind Prävalenzraten von 1,8 bis zu 78% vorzufinden. Polyurie, Durst und Polydipsie scheinen bei Älteren symptomatisch weniger ausgeprägt zu sein als bei jüngeren Erwachsenen, wobei die reduzierte Harnosmolarität einen Hinweis auf einen vorhandenen Diabetes insipidus liefert. Amilorid ist ein kaliumsparendes Diuretikum das den epithelialen Natriumkanal (ENaC) blockiert. Amilorid kann so die Entwicklung eines, Lithium bedingten Diabetes insipidus verhindern, indem es im distalen Nephron die Aufnahme von Lithium verringert.
Die Literatur definiert ein lithiumbedingtes akutes Nierenversagen als eine akute GFR-Reduktion, egal welchen Ausmaßes, begleitet von einer Erhöhung der Lithium-Plasmaspiegel von 1,5 mmol/l. Dieser cut-off Wert ist bei älteren Patienten niedriger. Eine akute Niereninsuffizienz, wie durch Lithium-Intoxikation bedingt, ist bei Älteren mit einem circa 10-fach erhöhten Risiko eine CKD zu entwickeln, assoziiert.
Eine der Konsequenzen einer akuten Lithiumintoxikation sind neben neurotoxischen Symptomen, wie Verwirrtheit, Tremor, Ataxie, Dysarthrie, Nystagmus, epileptische Anfälle, die Symptome einer akuten Niereninsuffizienz.
Wenn bei Hyponatriämie (Schwitzen/Erbrechen) die Natrium Load im Tubulus reduziert ist, die Lithium Reabsorption deswegen im prox Tubulus erhöht ist, und demensprechend weniger Lithium ausgeschieden wird, kann es rasch zu toxischen Plasmakonzentrationen kommen.
Medikamente die besonders oft im Alter verschrieben werden, wie beispielsweise ACE-Inhibitoren, Schleifendiuretika nichtsteroidale Antiphlogistika (NSAP) Cyclo-Oxygenase-2 (COX2) Inhibitoren sowie Angiotensin-IITyp-I-Rezeptorantagonisten, können zu einer Reduktion der GFR und infolge zu einer Lithiumintoxikation führen.
Xantine wie Theophilin und Coffein tendieren dazu die Lithiumkonzentration zu senken. Potentielles Intoxikationsrisiko besteht nach Absetzen von Xantinen nach längerer Einnahme mit einer Zunahme von 20-25 % der Plasma-Lithiumkonzentration. Dies hat eine praktische Bedeutung, wenn Patienten während ihres stationären Aufenthalts plötzlich Ihre Gepflogenheiten bezüglich Kaffee oder Tee Genusses verändern.
Ein anderes bedrohliches klinisches Szenario kann sich entwickeln, wenn sich eine bei Älteren oft anzutreffende Dehydratation zu einer altersbedingten GFR Reduktion hinzugesellt. Das Zusammenspiel dieser Risikofaktoren, besonders das einer mangelnden Flüssigkeitszufuhr kann zu einer Lithiumintoxikation mit anschließender akuter Niereninsuffizienz führen. Im Rahmen einer Dehydratation kann es bei älteren Patienten mit NDI zu einer lebensbedrohlichen Hypernatriämie kommen.
Bei älteren Patienten wurde über einen fünf Jahres Beobachtungszeitraum eine akute Niereninsuffizienz bei 1,3-7% berichtet. Die Mortalitätsrate bei akuter Niereninsuffizienz im Alter ist klein. Bei ambulanten geriatrischen Patienten waren erhebbare Lithiumintoxikationen mit einer abnormalen Nierenfunktion assoziiert (OR = 8.02; P = 0.02). Eine akute Niereninsuffizienz ist bei Älteren mit einem circa 10-fach erhöhten CKD Risiko assoziiert. Die Risikofaktoren zur Entwicklung einer akuten Niereninsuffizienz waren fortgeschrittenes Alter und frühere erhöhte Lithiumwerte.
Symptome einer akuten Lithiumintoxikation
leicht toxische Lithium-Serumkonzentrationen (1,5 – 2,0 mmol/l) sind geprägt durch zentralnervöse Symptome wie Lethargie, Schläfrigkeit und grobschlägiger Tremor und Muskelschwäche, sowie gastrointestinale Symptome wie Diarrhöen, Übelkeit und/oder Erbrechen. 2
Toxische Lithium-Serumkonzentrationen von 2,0 – 2,5 mmol/l induzieren Verwirrtheitszustände in Kombination mit cerebellären Symptomen (Dysarthrie, Ataxie, Nystagmus) prägen das Bild wobei manchmal auch extrapyramidale und neuromuskuläre Symptome wie Faszikulationen, und Myoklonien sowie Polyneuropathien sich hinzugesellen können. Renale Symptome wie Polyurie, Polydipsie oder nephrogener Diabetes insipidus können vorhanden sein. EKG-Veränderungen (abgeflachte oder negative T-Wellen) sind manchmal zu beobachten.
Bei hochtoxischen Lithium Serumkonzentrationen (ab 2,5 mmol/l) treten eine Bewusstseinsstörung, gesteigerte Sehnenreflexe, Krampfanfälle und Synkopen auf. Cardiovaskuläre Zeichen wie Arrythmien, niedriger Blutdruck bis hin zum Schockzustand können ebenso vorkommen wie ein akutes Atemnotsyndrom oder Hypo- aber auch Hyperthermien. Eine Niereninsuffizienz in Kombination mit anderen Symptomen führt zum Koma. Solch hochgradigen Lithiumintoxikationen führen bei Ausbleiben von Gegenmassnahmen zum Tod.
Die Symptome können mit zeitlicher Verzögerung auftreten.
Dies insbesonders wenn es sich beim Lithium um ein retardiertes Präparat handelt. In einigen dokumentierten Fällen wurde Spitzen-Plasmawerte, erst 12 Stunden nach Ingestion erreicht.
Klinisches Vorgehen bei Lithiumintoxikation
Die Induktion von Erbrechen, Magenauspumpen, Schutz der Atemwege und Legen eines zentralen Zugangs.
Die Gabe von Tierkohle, obwohl zur Absorbtion elektrisch geladener Teilchen wie Lithium-Salzen unbrauchbar, sollte gegeben werden um eventuell zusätzlich eingenommenen Medikamente zu neutralisieren.
Engmaschige Überwachung sowie andere supportive Maßnahmen sollten implementiert werden, da eine Dehydratation oft vorkommt. Daher sollten Kochsalzlösungen infundiert werden.
Bei schweren toxischen Symptomen sollte der Patient auf die Intensivstation verlegt werden, um eine engmaschige Überwachung zu gewährleisten, da manche Patienten die initial orientiert sind nach 24 – 48 Stunden einen kritischen Zustand entwickeln können.
Die Hämodialyse ist besser wirksam als die Gabe von Diuretika.
Die Peritonialdialyse schafft 15 ml/min und die Hämodialyse, die mittlerweile als der goldenene Standard betrachtet wird, filtert 50ml/min.
Die Indikation zur Dialyse besteht in der Schwere der klinischen Symptome, wie Koma, epileptische Anfälle, respiratorische Insuffizienz, sowie pharmakokinetische Überlegungen bezüglich Absorbtion (kontinuierliche gastrointestinale Absorption bei retardiertem Präparat), Verteilung (Gleichgewicht zwischen ZNS und Blut schon erreicht oder nicht) und Ausscheidung (Kreatinin- Clearance < 60ml/min und die Lithium-Clearance <20ml/min). Die Lithium-Clearance wird folgendermaßen berechnet: Lithium-Clearance = Lithiumkonzentration im Harn x Urinflow (ml/min) / Lithiumkonzentration im Plasma. Nach der Hämodialyse kommte es häufig zu Rebound-Mechanismen mit steigenden Konzentrationen im Plasma, die 6 – 12 Stunden später auftreten können. So muß eine Hämodialyse öfter wiederholt werden. Eine andere Modalität diese Rebound Phänomäne zu verhindern, ist eine kontinuierliche arterio-venöse oder veno-venöse Hämodialyse. Chronische irreversible nephropathische Veränderungen (CKD) mit oder ohne notwendige Nierenersatztherapie (ESRD) stellen eine zweite klinische Ausformung einer Nierenschädigung dar. Das morphologische Substrat der chronischen Nierenveränderungen ist durch eine interstitielle Fibrose, eine Glomerulosklerose sowie der Entstehung von Zysten charakterisiert. Die Langzeitgabe von Lithium über mehrere Jahre ist assoziiert mit einem kontinuierlichen Rückgang der GFR, der circa 30 % über dem zu erwartendem altersbedingtem Wert liegt. Patienten unter Lithium zeigten eine Reduktion der eGFR um jährlich 0,64 bis 0,73 ml/min/1.73 m2. Dazu kommen noch die Alterseffekte, die in einer kontinuierlichen Abnahme der GFR über die Zeit bestehen. Ab dem 45.ten Lebensjahr nimmt die GFR physiologischerweise im Ausmaß von 8 ml/min/10Jahre und ab dem 70.ten LJ 10ml/min/10Jahre, ab. Diese chronischen Nephropathien entwickeln sich im Schnitt nach 15-20 Jahren, sind aber fast immer mild und oft klinisch nicht relevant. Studien zeigen ein 2- bis 3-fach erhöhtes CKD Risiko unter gemischtaltrigen Lithium-Patienten. Obwohl direkte Vergleiche der Prävalenzdaten zwischen jungen und älteren Lithium-Patienten fehlen, gibt es Daten aus gemischtaltrigen Sampels. So sind die hier gefundenen Prävalenzraten bei älteren Patienten von 1,2-17% doch deutlich niedriger als die 69 % der gemischtaltrigen Samples. Die Prävalenzdaten bei älteren Patienten im Vergleich zur Allgemeinbevölkerung mit 13,1% (Stadium 1-4) nicht exzessiv erhöht. Dies ist umso erstaunlicher da ältere Patienten hohe Raten an kardiovaskulären Erkrankungen, bei den Risikofaktoren wie oxydativer Stress und entzündliche Veränderungen als gemeinsame Ätiologie mit affektiven Erkrankungen aufweisen. Risikofaktoren sind höhere mediane Lithiumspiegel und die Dauer der Therapie beinhalten ein höheres Risiko später eine chronische Nephropathie zu entwickeln. Zusätzliche Risikofaktoren waren, niedrige initiale GFR d.h. eine bereits vorgeschädigte Niere, höheres Alter, weibliches Geschlecht, somatische Komorbiditäten wie erhöhter Blutdruck, ein metabolisches Syndrom, ein vorbestehendes NDI und Lithium-Intoxikationen. Dies macht ein kontinuierliches Monitoring umso wichtiger. Niederdosierte Lithium-Langzeitgabe bei älteren Patienten zeigt keine Beeinträchtigung der renalen Funktion zur Folge. So kann man resümieren, dass die Dosis das Gift macht. Aber auch adäquate Managementkriterien können die Entwicklung von Nierenschäden unter Lithium nicht vollkommen eliminieren. Bei > 55-jährigen Patienten mit Lithiumtherapie wird die Prävalenz der renalen Ersatztherapie auf 1,5% geschätzt. Dies ist eine, im Vergleich zur Allgemeinbevölkerung 2,5 bis 8-fach erhöhte Rate.
Eine Kohortenstudie von 3369 Patienten unter Lithiumtherapie wurden 18 mit Lithiumbedingtem Endstadium einer Niereninsuffizienz identifiziert. Es waren 0,5% im Vergleich zur Allgemeinbevölkerung von 0,2%. Nierenversagen, die eine Nierenersatztherapie (Dialyse, Transplantation) notwendig machen, sind rar, kommen aber in Einzelfällen vor. Risikofaktoren für die Entstehung des Endstadiums einer Niereninsuffizienz (ESRD) sind vorhergehende NDI und CKD.
Procedere bei Entwicklung einer CKD
Die Literatur ist widersprüchlich.
Range: Ausschleichen (über 8 Wochen) nach zwei positiven Tests bis Lithium weitergeben.
Ausschleichen von Lithium
Unklarheit herrscht ob nach Ausschleichen von Lithium es zu einer Regeneration kommt.
Manche Autoren sprechen von einem GFR cut-off Wert „point of no return“ von 40-25 ml/min. Über diesen Werten scheint die Niere regenerationsfähig.
Manch andere Autoren sprechen von unsichere Wiederherstellung der Funktion nach Ausschleichen.
Weitergabe von Lithium in adäquater Dosis
Ein auf statistischen Modellen beruhender Therapie-Algorithmus wie bei Einschränkung der renalen Funktion mit Lithium zu verfahren ist wurde erstellt.
Es wurde das Risiko einer ESRD-Entwicklung versus das Risiko an Suizid zu versterben abgewogen.
Die Entscheidung nach 20 Jahren bei Patienten mit Zeichen einer CKD, Lithium auszuschleichen ist nur sinnvoll wenn die Wahrscheinlichkeit zur Progression einer ESRD mehr wie 41,3% beträgt.
Weitergabe von Lithium in reduzierter Dosis
Klinische Konsequenzen und Unklarheiten über die Regenerationsfähigkeit der Niere.
Da CKD Patienten für Lithiumintoxikationen gefährdet sind braucht es ein engmaschisches Monitoring der Nierenwerte z.B. mit Lithium Monitoring Buch.
Lithium und Nebenschilddrüse
Eine persistierende Hyperkalzämie in Zusammenhang mit einer Langzeit-Lithium-Therapie wurde erstmals 1973 beschrieben. Die Hyperkalzämie wurde 1978 auf einen Hyperparathyreoidismus zurückgeführt.
Eine Hypercalzämie tritt je nach Literatur bei 15 – 20% bis 10-42% der Patienten. Dabei kann das Phosphat normal oder erniedrigt sein.
Bei 29% sind die Parathormon-Spiegel eindeutig erhöht. Ebenfalls ist, als gegenregulatorischer Mechanismus auch die renale Reabsorption von Calcium erhöht. Es kommt wahrscheinlich, nicht wie beim primären Hyperparathyreoidismus, zu einer Knochenresorption.
Symptome einer Hypercalzämie
Psychiatrische Symptomatik Konzentrations- und Gedächtnisstörungen,
Antriebsstörungen,
Depressionen und Manien
Verwirrtheit, Bewusstseinstrübung,
Koma
Muskuläre Symptomatik: Muskelschwäche und Hyporeflexie
Renale Symptomatik :
Polyurie, Polydipsie, Dehydratation,
Elektrolytverlust, Nephrolithiasis,
Nephrokalzinose
Kardiale Symptomatik: Verkürzung der QT-Zeit,
Herzrhythmusstörungen,
arterielle Hypertonie
Gastrointestinale Symptomatik: Appetitlosigkeit, Übelkeit, Erbrechen,
Obstipation, Ulzerationen, Pankreatitis
(selten), Gewichtsverlust.
Konservatives Vorgehen bei Calcium < 2,75 mmol/l.
Ausschleichen von Lithium und Umstellung auf einen anderen SST bei klinischer Manifestation einer Hypercalcämie.
Therapeutisch ist die Gabe von Cinacalcet möglich.
Cinacalcet ist ein allosterischer Modulator des calciumsensitiven Rezeptors. Dies bewirkt eine Erhöhung der Empfindlichkeit des Rezeptors für Calcium und zu einer verminderten Freisetzung des Knochenstoffwechselhormons Parathormon.
Operatives Vorgehen: Nebenschilddrüsenablation möglich.
Schilddrüsenveränderungen unter Lithium
Lithium übt über 7 verschiedene Mechanismen einen thyreostatischen Einfluss auf den Schilddrüsenstoffwechsel aus indem es den Einbau von Iod in das Schilddrüsenhormon verhindert.
In der Regel können körpereigene Regulationsmechanismen über Erhöhung des TSH (Thyreotropin) einen euthyreoten Zustand aufrechterhalten. Auch die Entwicklung einer Struma ist ein solcher Mechanismus. Wegen der bei einer Struma gegebenen Gefahr des weiteren Wachstums mit Ausbildung von Lokalsymptomen, wegen des erhöhten Karzinomrisikos und der gehäuften Entwicklung von Schilddrüsenautonomien sollte ein euthyreote Lithiumstruma – wie auch eine Iodmangelstruma – behandelt werden.
In einigen Fällen kann es aber auch zu einer klinisch bedeutsamen und behandlungsbedürftigen Hypothyreose und – in seltenen Fällen- auch zu einer Hyperthyreose kommmen.
Bipolare Störungen sind per se oft mit Hypothyreose verbunden. Ein klinischer Hypothyreoidismus wurde in 8-19% aller Patienten unter Lithium gefunden. (Allgemeinbevölkerung mit 0,5-1,8%)
Ein subklinischen Hypothyreoidismus lag für Lithium-Patienten bei 23% vor.
Typischerweise manifestieren sich diese Symptome in den ersten 3-6 Behandlungswochen.
Die Lithiummedikation sollte nach Auftreten einer Schilddrüsenüberfunktion nicht beendet werden, da sonst die Gefahr einer Verstärkung der hyperthyreoten Dekompensation droht.
Bei einer maniformen Symptomatik muß die Möglichkeit bedacht werden, daß sich hierdurch nicht ein Rezidiv der affektiven Symptomatik sondern eine manifeste Hyperthyreose äußern kann.
Die Behandlung erfolgt mit L-Thyroxin (50–150 mg/d), was eine zuverlässige und risikoarme Therapie darstellt.